

Вода, лед и пары воды
В одном решающем отношении Земля не имеет себе аналогов в Солнечной системе - это единственное из вращающихся вокруг Солнца тел, на поверхности которого существует жидкая вода. В самом деле, на Земле имеются не "следы" воды, как на некоторых планетах, а ее необъятные количества. Более 70% земной поверхности покрыто океанами, которые содержат столько воды, что если распределить ее равномерно по всему земному шару, то образуется слой толщиной около 2700 м. Инопланетному наблюдателю трудно было бы поверить, что на таком богатом водой космическом теле, как Земля, существуют обширные области, где вода (точнее, ее нехватка) является фактором, ограничивающим возможность жизни. Тем не менее это так. Пустыни, которые занимают одну пятую площади суши, красноречиво свидетельствуют о важности постоянного присутствия жидкой воды для существования жизни на нашей планете.
До 1963 г. вопрос о наличии воды на Марсе по-прежнему оставался открытым, как, впрочем, и большинство других проблем, связанных с этой планетой. К 1970 г., т.е. за пять лет до запуска "Викингов", наблюдения, проведенные с Земли и с помощью космических аппаратов, со всей очевидностью показали, что недостаток воды - основное препятствие для возникновения любой предполагаемой марсианской биосферы. Полное представление об этом сложилось после полета "Маринера-9" и особенно орбитальных аппаратов "Викинг", которые осуществили съемку распределения паров воды на Марсе в зависимости как от местоположения, так и от времени года. Данные, полученные с помощью инфракрасных спектрометров, установленных на орбитальных аппаратах, показали абсолютную сухость марсианской пустыни. Но чтобы в полной мере оценить этот факт, коротко напомним сначала основные физико-химические свойства воды.
Как и многие другие соединения, вода существует в трех состояниях (или фазах): твердом, жидком и газообразном, легко переходя из одного состояния в другое. Если оставить в комнате открытый сосуд с жидкой водой, то ее молекулы начнут отрываться от поверхности жидкости и улетучиваться, включаясь в состав воздуха комнаты в виде паров. Некоторые из этих молекул могут вновь попасть в сосуд, присоединившись к жидкости, однако в основном их перемещение происходит в одном направлении-в результате жидкость испаряется. Чтобы избежать испарения, сосуд можно закрыть, в этом случае пространство над жидкостью в сосуде вскоре насыщается парами, и тогда скорость конденсации пара станет равной скорости испарения с поверхности жидкости. С этого момента система в целом больше не меняется; в таком случае говорят, что она находится в равновесии. Давление водяного пара при равновесии (статическое давление) можно измерить, причем оно зависит от температуры: чем выше температура, тем выше давление. Например, при 25°С давление паров в состоянии равновесия равняется 31,7 мбар, или примерно 0,03 атм. Это означает, что система стабильна при 25°С до тех пор, пока давление паров воды в окружающей среде равняется 31,7 мбар. При более низком давлении пара вода испаряется, а при более высоком пар конденсируется, пока вновь не установится равновесие. При 100°С статическое давление пара на уровне моря составляет 1013 мбар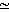 1 атм. При этом в жидкой фазе начинают образовываться пузыри-в таком случае говоря!, что вода кипит.
1 атм. При этом в жидкой фазе начинают образовываться пузыри-в таком случае говоря!, что вода кипит.
Теперь понизим температуру ниже точки замерзания, чтобы жидкая вода превратилась в лед. Так как лед испаряется в сухом воздухе, пары над ним также создают определенное давление. Скажем, при температуре - 20°С давление паров льда равно 1,0 мбар, при - 10°С оно составляет 2,6 мбар. В воздухе с более низким давлением водяного пара лед испаряется, или возгоняется. Если давление водяного пара выше, то пар конденсируется прямо в лед-именно такой процесс происходит при образовании инея в холодную ясную ночь. В обоих случаях осуществляется непосредственный переход пара в твердое состояние или, наоборот, без образования жидкой воды.
В рассмотренных примерах речь идет не более чем о двух фазах: пар и вода либо пёр" и лед. Увеличивая давление, можно вызвать таяние льда, приведя тем самым воду и лед в состояние равновесия при температурах ниже 0°С без газообразной фазы. Чтобы привести все три фазы в равновесие, необходимо установить температуру около 0°С, когда равновесное давление паров воды и льда равно 6,1 мбар. Это состояние равновесия трех фаз называется тройной точкой. Для наших целей важно знать величину давления в тройной точке, поскольку это самое низкое давление, при котором может существовать чистая жидкая вода*.
* (Следует помнить, что величина 6,1 мбар относится к давлению паров воды, а не к общему атмосферному давлению, как иногда указывают. )
Все сказанное выше относится лишь к чистой воде, которая редко встречается в природе. Даже дождевая вода содержит растворенные атмосферные газы, а вода озер, рек и океанов-еще и растворенные соли. Наличие в воде растворенных веществ (или какого-то другого растворителя) приводит к уменьшению равновесного давления ее паров, а это в свою очередь влечет за собой понижение температуры точки замерзания и повышение температуры точки кипения. Насколько сильно проявляются эти эффекты, зависит от концентрации растворенных веществ. Концентрированные растворы могут существенно отличаться в этом отношении от чистой воды, а слабые растворы - лишь незначительно. Согласно закону Рауля, давление паров слабых растворов пропорционально доле молекул воды в растворе.
Приведем несколько примеров. Давление паров над раствором сахарозы, в котором на одну молекулу сахара приходится 99 молекул воды (16%-й раствор по массе), почти точно составляет 99% давления паров над чистой водой при той же температуре. Температура точки замерзания такого раствора равна - 1,10°С. Морская вода представляет собой сложную смесь солей, равновесное давление паров составляет 99% их давления над чистой водой при той же температуре, а замерзает морская вода при температуре - 1,87°С. Из закона Рауля следует, что 98% молекул в морской воде приходится на долю чистой воды. (Если речь идет об электролитах, как в данном случае, то ионы рассматриваются как молекулы.) Большое Соленое озеро, как и многие другие соленые озера, насыщено или почти насыщено хлоридом натрия (NaCl - бытовая поваренная соль). Давление паров насыщенного раствора NaCl составляет 75% от давления паров чистой воды, а его температура замерзания близка к - 21°С. Доля молекул воды в этом растворе составляет 82% (при такой высокой концентрации солей закон Рауля выполняется лишь приближенно). Другая соль, хлорид кальция (СаСl2), редко встречается в природе, но в одном из водоемов Антарктиды (о нем говорится далее в этой главе) она содержится в насыщающей концентрации. Температура точки замерзания насыщенного раствора хлорида кальция равна -51ºС, а равновесное давление его паров при комнатной температуре составляет только 31 % от равновесного давления паров чистой воды.
Как видно из этих примеров, добавление к воде растворенных веществ стабилизирует жидкую фазу при более низких (по сравнению с чистой водой) значениях давления пара и температуры. До экспедиции "Викингов" предполагалось, что благодаря этому эффекту на поверхности Марса может существовать жидкая вода. Далее мы проанализируем это предположение наряду с некоторыми данными о биологической пригодности воды, содержащей высокие концентрации растворенных веществ.


